Fabio Artosi
UOSD Dermatologia, Università di Roma Tor Vergata
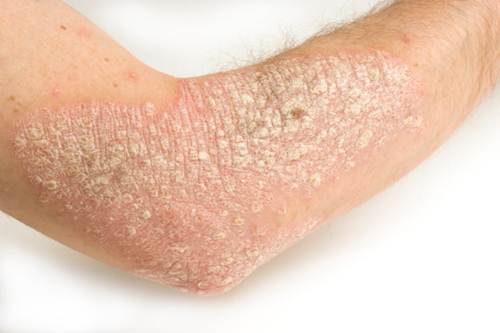
L’IL-23 è una citochina prodotta da numerose cellule del sistema immunitario la cui disregolazione può portare a condizioni patologiche come la psoriasi e l’artrite psoriasica. È stata scoperta da poco oltre 20 anni e solo recentemente si è compreso in maniera più chiara il suo ruolo nei processi infiammatori dell’organismo, come nella psoriasi e nell’artrite psoriasica. La psoriasi è una patologia infiammatoria sistemica, cronico-recidivante, a prevalente interessamento cutaneo, caratterizzata da una patogenesi non del tutto chiarita, ma che comprende indubbiamente molteplici passaggi immunologici e numerosi attori appartenenti a diverse tipologie cellulari del sistema immunitario. Dopo un iniziale rilascio, a seguito di un trigger ambientale, di diversi autoantigeni tra i quali ADAMTSL5, KERATIN 17, antigeni lipidici generati dalla fosfolipasi a2 del gruppo IVD, DNA ed RNA self (complessati con LL37) hBD2, LCN2 ed S100, le cellule dendritiche plasmacitoidi avviano la vera e propria risposta infiammatoria mediante il rilascio di IFN-α. Con la successiva attivazione delle cellule dendritiche dermiche si ha il rilascio di grandi quantità di IL-12 ed IL-23 che comportano il coinvolgimento dell’immunità acquisita nelle fasi ancora iniziali della formazione della placca psoriasica, favorendo la differenziazione dei Th naive in Th1, Th17 e Th22 nel derma della cute sede del processo infiammatorio.
In questa fase della patogenesi si selezionano due gruppi di cellule che tra di loro instaurano un vero e proprio feedback positivo che auto-alimenta il processo infiammatorio portando alla formazione della placca psoriasica. Da una parte i linfociti Th17, i linfociti T17 citotossici e le cellule linfoidi innate di tipo 3 che secernono IL-17; dall’altra i cheratinociti, i macrofagi dermici e le cellule dendritiche dermiche attivate che sintetizzano IL-23 oltre ad altre citochine come TNF-α proprio in risposta all’IL-17. È ormai noto che l’IL-23 rappresenti una citochina trofica per la popolazione di linfociti Th-17, garantendone il mantenimento, ma anche l’espansione e l’attivazione in risposta a trigger antigenici. Di più recente individuazione è il ruolo dell’IL-23 nel favorire la sintesi della cheratina 16 coinvolta nel richiamo dal circolo dei neutrofili.
L’IL-17 a sua volta attiva i cheratinociti e stimola la produzione ed il rilascio di peptidi antimicrobici che perpetuano un continuo stimolo nei confronti dell’immunità innata, inoltre induce direttamente iperplasia epidermica.
Non si conosce con lo stesso livello di dettaglio la patogenesi immunologica dell’artrite psoriasica, ma è ampiamente noto da anni il ruolo che svolgano gli anticorpi monoclonali inibitori dell’IL-17 e dell’IL-23 nel modulare negativamente questa sorta di cortocircuito citochinico che avviene nella genesi della psoriasi, sortendo un effetto positivo sull’eventuale presenza/copresenza dell’artrite psoriasica, migliorandone i segni, i sintomi e rallentando la progressione del danno articolare. Ad oggi in Europa, tra gli anti-IL-23 risultano approvati per l’artrite psoriasica il risankizumab, il guselkumab e l’ustekinumab ed ulteriori studi sono in corso per l’approvazione del tildrakizumab che, al momento, risulta approvato solo per la forma cutanea della psoriasi. Com’è possibile dedurre dalla complessa immunopatogenesi della psoriasi gli anti IL-23 bloccano il cortocircuito ad un livello più alto rispetto agli anti IL-17, potendo bloccare “a monte” lo stimolo proliferativo nei confronti dei Th17, esecutori immunitari finali della formazione della placca psoriasica, quindi modulando senza bloccare la fisiologica risposta dei Th17, coinvolta in numerose risposte immunitarie fisiologiche. Per tali ragioni gli inibitori dell’IL-23 sono pressoché privi di effetti collaterali e presentano uno schema posologico estremamente favorevole, con somministrazioni distanziate di 12 settimane l’una dall’altra nel mantenimento.
Bibliografia
- Zhou, X.; Chen, Y.; Cui, L.; Shi, Y.; Guo, C. Advances in the Pathogenesis of Psoriasis: From Keratinocyte Perspective. Cell Death Dis 2022, 13, 81, doi:10.1038/s41419-022-04523-3.
- Hawkes, J.E.; Yan, B.Y.; Chan, T.C.; Krueger, J.G. Discovery of the IL-23/IL-17 Signaling Pathway and the Treatment of Psoriasis. J.I. 2018, 201, 1605–1613, doi:10.4049/jimmunol.1800013.
- Martin, D.A.; Towne, J.E.; Kricorian, G.; Klekotka, P.; Gudjonsson, J.E.; Krueger, J.G.; Russell, C.B. The Emerging Role of IL-17 in the Pathogenesis of Psoriasis: Preclinical and Clinical Findings. Journal of Investigative Dermatology 2013, 133, 17–26, doi:10.1038/jid.2012.194.
- Chan, T.C.; Hawkes, J.E.; Krueger, J.G. Interleukin 23 in the Skin: Role in Psoriasis Pathogenesis and Selective Interleukin 23 Blockade as Treatment. Therapeutic Advances in Chronic Disease 2018, 9, 111–119, doi:10.1177/2040622318759282.
- Boehncke, W.-H.; Brembilla, N.C.; Nissen, M.J. Guselkumab: The First Selective IL-23 Inhibitor for Active Psoriatic Arthritis in Adults. Expert Review of Clinical Immunology 2021, 17, 5–13, doi:10.1080/1744666X.2020.1857733.
- Steel, K.J.A.; Srenathan, U.; Ridley, M.; Durham, L.E.; Wu, S.; Ryan, S.E.; Hughes, C.D.; Chan, E.; Kirkham, B.W.; Taams, L.S. Polyfunctional, Proinflammatory, Tissue‐Resident Memory Phenotype and Function of Synovial Interleukin‐17A+ CD 8+ T Cells in Psoriatic Arthritis. Arthritis Rheumatol 2020, 72, 435–447, doi:10.1002/art.41156.