Flavia Lozzi
UO di Dermatologia. Policlinico Universitario di Roma Tor Vergata
Il carcinoma a cellule di Merkel (CCM) è una neoplasia cutanea rara ad altro grado di malignità, ad oggi seconda causa di morte per neoplasia cutanea dopo il melanoma. L’incidenza annuale è stata stimata essere di 0,79 su 100.00 abitanti negli Stati Uniti, lievemente inferiore in Europa e maggiore in Australia. In Italia si stimano circa 240 nuove diagnosi l’anno con una prevalenza stimata di circa 1400 casi. L’incidenza aumenta con l’aumentare dell’età, con un’età media di insorgenza di 76 anni. La patologia colpisce in misura lievemente maggiore il sesso maschile e in misura maggiore la popolazione bianca (1). Il CCM presenta una maggior incidenza nei pazienti con fototipo chiaro, immunodepressi o nei pazienti affetti da altre neoplasie (2).
Il CCM, inizialmente definito da Toker come carcinoma trabecolare, è considerato una neoplasia neuroendocrina in quanto le cellule di Merkel assomigliano alle cellule del sistema neuroendocrino diffuso ed esprimono marcatori tipici di tali cellule, quali cromogranina-A, CD56 ed NSE. Tuttavia è ancora discussa la reale derivazione di questa neoplasia. Secondo alcune ipotesi il CCM originerebbe da cellule staminali epidermiche o dermiche o dai linfociti B (2).
La maggior parte dei CCM mostra la presenza del DNA del polyoma virus del Merkel (MCPyV) che agirebbe da promotore della trasformazione neoplastica. Il danno genomico UV-correlato sembrerebbe rivestire un ruolo importante nell’ insorgenza della neoplasia, soprattutto nei casi in cui non si evidenzia la presenza del genoma virale. I casi MCpyV negativi mostrano un comportamento clinico più aggressivo (1).
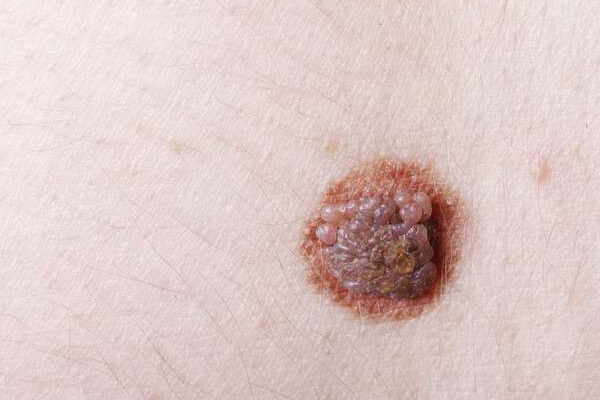
La presentazione clinica del CCM può essere riassunta dall’acronimo inglese AEIOU: asymptomatic/lack of tenderness, expanding rapidly, immune suppression, older than 50 years, and ultraviolet-exposed site on a person with fair skin. La lesione appare di colorazione variabile dal roseo al rosso bluastro, a superficie lisca e lucida che solo raramente va incontro a ulcerazione (1). La sede anatomica più frequentemente colpita è il distretto testa-collo (48%), seguito da arti superiori e spalle (24%). La diagnosi differenziale si pone con altre lesioni maligne e benigne (carcinoma basocellulare, carcinoma spinocellulare, melanoma amelanotico, tumori annessiali, cisti e lipomi). Dal punto di vista immunofenotipico, l’espressione della citocheratina 20 (CK20) sembra essere un marker altamente sensibile e specifico per la diagnosi di CCM (1).
La stadiazione dei pazienti con CCM fa riferimento alla classificazione TNM AJCC, di cui è oggi disponibile l’ottava versione. La percentuale di sopravvivenza a 5 anni è riportata essere del 64% nella malattia localizzata, del 39% nella malattia localmente avanzata e del 18% nella malattia metastatica (2).
Nella patologia localizzata deve essere in prima linea garantita la radicalità chirurgica nonostante non ci sia accordo universale sui margini chirurgici da adottare. È indicata la biopsia del linfonodo sentinella che in caso di positività orienta verso la linfoadenectomia, con o senza radioterapia adiuvante. Non è in questo stadio raccomandata chemioterapia adiuvante (3).
Per la malattia localmente avanzata, la radioterapia locoregionale ha mostrato una riduzione del rischio di recidiva, mentre la chemioterapia non sembra apportare un chiaro beneficio (4,5). Sono tuttavia in corso studi con anticorpi anti-PD-1/PD-L1 nel CCM localmente avanzato ad alto rischio di recidiva.
Per la patologia metastatica l’approccio classico prevedeva la chemioterapia con regimi di combinazione di platino ed etoposide, con risposte raramente durevoli nonostante l’iniziale chemiosensibilità della neoplasia. Negli ultimi anni, tuttavia, le nuove terapie con inibitori dei checkpoint immunitari si sono dimostrate significativamente più attive ed efficaci della chemioterapia (2). Gli anticorpi anti-PD-1/PD-L1 hanno dimostrato di essere efficaci nel trattamento del CCM metastatico con tassi di risposta in prima linea del 56-73% e con una mediana di PFS di 17 mesi. Nelle linee avanzate di trattamento invece è stato evidenziato un tasso di risposta minore. FDA ed EMA hanno approvato avelumab, un anticorpo monoclonale completamente umano tipo IgG1 diretto contro PD-L1, per il trattamento in monoterapia del CCM metastatico nei pazienti sia naïve che precedentemente trattati con chemioterapia (6). Recentemente l’FDA ha approvato il Pembrolizumab per il trattamento del CCM avanzato. Altri inibitori dei checkpoint immunitari e loro combinazioni sono attualmente in fase di studio per il CCM avanzato (2).
Bibliografia:
- Harms PW et al. Update on Merkel Cell Carcinoma. Clin Lab Med. 2017 Sep; 37(3):485-501. Epub 2017 Jun 13.
- Carcinoma a cellule di Merkel. Il Pensiero Scientifico Editore. Collana di Immuno-Oncologia. 2018. Volume 6.
- Sims JR et al. Sentinel lymph node biopsy in Merkel cell carcinoma: The Mayo Clinic experience of 150 patients. Surg Oncol. 2018 Mar; 27(1):11-17. Epub 2017 Oct 26.
- Bhatia S et al. Adjuvant Radiation Therapy and Chemotherapy in Merkel Cell Carcinoma: Survival Analyses of 6908 Cases From the National Cancer Data Base. J Natl Cancer Inst. 2016 May 31; 108(9). Print 2016 Sep.
- Servy A et al. Merkel cell carcinoma: value of sentinel lymph-node status and adjuvant radiation therapy. Ann Oncol. 2016 May; 27(5):914-9. Epub 2016 Jan 24.
- NCCN 2018 GUIDELINES.