Dionisio Silvaggio1, Mauro Bavetta1, Pietro Sollena2
1 Unità di Dermatologia, Fondazione Policlinico Universitario “Tor Vergata”, Roma
2 Unità di Dermatologia, Fondazione Policlinico Universitario A. Gemelli IRCCS, Roma
Negli ultimi decenni, diversi farmaci con specifici target molecolari sono stati sviluppati e introdotti per il trattamento dei pazienti oncologici. Tra gli altri, importanti risultati sono stati raggiunti utilizzando gli inibitori del recettore del fattore di crescita epidermico (EGFRi).
L’EGFR fa parte di una famiglia di recettori di membrana tirosin-chinasici (TK) di tipo I, il cui ruolo nella patogenesi e nello sviluppo di tumori epiteliali maligni è ben noto. (1,2)
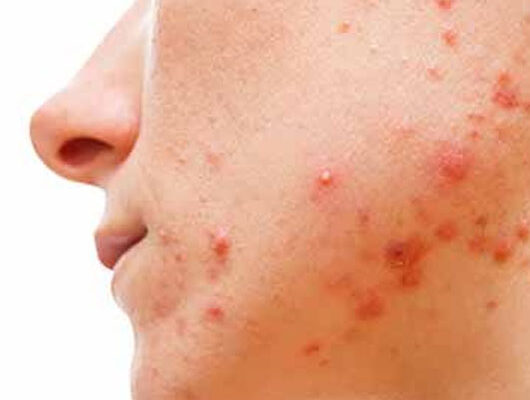
Gli agenti anti-EGFR sono approvati da FDA ed EMA come opzione terapeutica nei tumori solidi del colon-retto, testa-collo, seno e polmone. Tra i possibili eventi avversi in corso di terapia con EGFRi, l’eruzione cutanea papulo-pustolosa è l’evento più frequente.
Poiché l’uso delle tetracicline ha ridotto solo parzialmente l’incidenza dell’eruzione cutanea, nuove molecole sono necessarie per migliorare il disagio del paziente ed evitare la necessità di interrompere o ridurre il dosaggio durante la terapia con anti-EGFR, con possibili conseguenze negative sull’outcome della malattia oncologica primaria. I farmaci topici generalmente utilizzati in associazione alla minociclina sono i corticosteroidi e gli emollienti, con beneficio parziale e momentaneo.
La polidatina è la forma glicosilata e precursore naturale del resveratrolo, con attività antinfiammatorie e antiossidanti. Un trial clinico eseguito in collaborazione tra il Policlinico Tor Vergata ed il Policlinico A. Gemelli ha valutato l’efficacia di un prodotto topico contenente polidatina nella prevenzione e nel trattamento dell’eruzione cutanea associata alle terapie anti-EGFR in pazienti affetti da cancro al colon, al retto, ai polmoni e alla laringe.
Tutti i 40 pazienti oncologici idonei alla terapia topica, in trattamento con anti-EGFR, sono stati divisi in due gruppi, il gruppo A comprendente i pazienti che presentavano un’eruzione cutanea al basale e il gruppo B comprendente i pazienti senza manifestazioni cutanee al momento dell’arruolamento, al fine di studiare il possibile effetto preventivo della polidatina in questo gruppo. Il protocollo di studio prevedeva un’applicazione locale bigiornaliera della crema polidatina alla concentrazione 0,8% (gruppo B) o 1,5% (gruppo A) per 24 settimane consecutive.
Nel corso del trial, i pazienti sono stati visitati ogni 4 settimane per le prime dodici settimane (T0, T4, T8 e T12) e successivamente dopo altre 12 settimane (T24).
Per la valutazione della tossicità cutanea, delle membrane mucose e pseudomucose e degli annessi cutanei, è stata utilizzata la scala di classificazione NCI-CTCAE (National Cancer Institute – Common Terminology Criteria for Adverse Events). Durante ogni visita veniva inoltre somministrato il questionario sulla qualità della vita (DLQI) e valutata la sintomatologia pruriginosa utilizzando la scala Visuale Analogica del prurito (VAS).
Al termine dello studio è stato osservato un miglioramento statisticamente significativo del NCI-CTCAE (p=0,0006) alla settimana 4 nel gruppo A. Lo stesso risultato è stato osservato nei punteggi di DLQI e VAS prurito alla settimana 4, con una rilevanza statistica rispettivamente di p=0,0180 e p=0. Per quanto riguarda il gruppo-B, trattato con il prodotto a base di polidatina ad una minore concentrazione, non sono comparse manifestazioni cliniche indicative di tossicità cutanea, ad eccezione di un paziente che al T4 presentava un lieve eritema del volto (NCI-CTCAE=1). Il valore medio del NCI-CTCAE ha mostrato una tendenza esponenzialmente decrescente fino alla settimana 24. Non è stato segnalato alcun evento avverso dovuto all’applicazione topica di polidatina.
Se i dati fossero confermati da ulteriori studi, possibilmente con una casistica più ampia e/o con un gruppo placebo di controllo, la polidatina potrebbe essere inclusa nell’ambito delle future linee guida di trattamento topico, nella gestione e prevenzione delle tossicità cutanee in corso di anti-EGFR, riducendo l’utilizzo degli steroidi. I risultati dello studio pilota dimostrano la capacità di controllare in modo rapido e sicuro le reazioni papulo-pustolose di grado lieve-moderato EGFRi-associate e di prevenire le frequenti recidive cutanee correlate ai vari cicli di terapia antineoplastica a cui i pazienti devono necessariamente sottoporsi.
Bibliografia
- Mendelsohn J, Baselga J. Epidermal growth factor receptor targeting in cancer. Semin Oncol. agosto 2006;33(4):369–85.
- Wang Z. ErbB Receptors and Cancer. Methods Mol Biol Clifton NJ. 2017;1652:3–35.
- Uozumi S, Enokida T, Suzuki S, Nishizawa A, Kamata H, Okano T, et al. Predictive Value of Cetuximab-Induced Skin Toxicity in Recurrent or Metastatic Squamous Cell Carcinoma of the Head and NECK. Front Oncol. 2018;8:616.
- Bonner JA, Harari PM, Giralt J, Cohen RB, Jones CU, Sur RK, et al. Radiotherapy plus cetuximab for locoregionally advanced head and neck cancer: 5-year survival data from a phase 3 randomised trial, and relation between cetuximab-induced rash and survival. Lancet Oncol. Jan 2010;11(1):21–8.
- Orditura M, De Vita F, Galizia G, Lieto E, Vecchione L, Vitiello F, et al. Correlation between efficacy and skin rash occurrence following treatment with the epidermal growth factor receptor inhibitor cetuximab: a single institution retrospective analysis. Oncol Rep. Apr 2009;21(4):1023–8.
- Loprinzi CL. Minocycline for preventing EGFR inhibitor-induced rash. Curr Oncol Rep. Jul 2008;10(4):303.
- Yamada M, Iihara H, Fujii H, Ishihara M, Matsuhashi N, Takahashi T, et al. Prophylactic Effect of Oral Minocycline in Combination with Topical Steroid and Skin Care Against Panitumumab-induced Acneiform Rash in Metastatic Colorectal Cancer Patients. Anticancer Res. Nov 2015;35(11):6175–81.